Tiêu chuẩn quốc gia TCVN 8710-3:2019 yêu về việc chẩn đoán lâm sàng trong việc chẩn đoán bệnh đốm trắng ở tôm do vi rút?
- Tiêu chuẩn quốc gia TCVN 8710-3:2019 yêu về việc chẩn đoán lâm sàng trong việc chẩn đoán bệnh đốm trắng ở tôm do vi rút ra sao?
- Việc chẩn đoán trong phòng thí nghiệm bằng phương pháp Nested PCR (Polymerase Chain Reaction) được quy định như thế nào?
- Việc chẩn đoán trong phòng thí nghiệm bằng phương pháp Realtime PCR được quy định như thế nào?
Tiêu chuẩn quốc gia TCVN 8710-3:2019 yêu về việc chẩn đoán lâm sàng trong việc chẩn đoán bệnh đốm trắng ở tôm do vi rút ra sao?
Tại Mục 5 Tiêu chuẩn quốc gia TCVN 8710-3:2019 yêu cầu về việc chẩn đoán lâm sàng trong việc chẩn đoán bệnh đốm trắng ở tôm do vi rút:
* Đặc điểm dịch tễ
Bệnh thường xảy ra trên các loài tôm thuộc họ tôm he (Penaeidae) như tôm sú (Penaeus monodon), tôm thẻ chân trắng (P. vannamei), tôm rảo (P. merguensis).
Ngoài ra còn một số loài như tôm đất, tôm càng xanh, cua, ghẹ, các loài giáp xác phù du như Artemia, Copepoda có thể mang mầm bệnh.
Bệnh xảy ra ở hầu hết các giai đoạn phát triển của tôm như ở cả tôm nước mặn, lợ.
Vi rút có thể lây lan theo chiều ngang từ cá thể bị nhiễm bệnh sang cá thể khỏe trong cùng ao hoặc có thể do tôm ăn thức ăn có mầm bệnh; hoặc qua các vật chủ trung gian như tôm tự nhiên, cua, ghẹ, động vật phù du mang mầm bệnh.
Bệnh đốm trắng xuất hiện quanh năm, đặc biệt khi thời tiết biến đổi nhiều như biên độ nhiệt độ trong ngày biến thiên quá lớn, thay đổi độ mặn gây sốc cho tôm.
* Triệu chứng lâm sàng
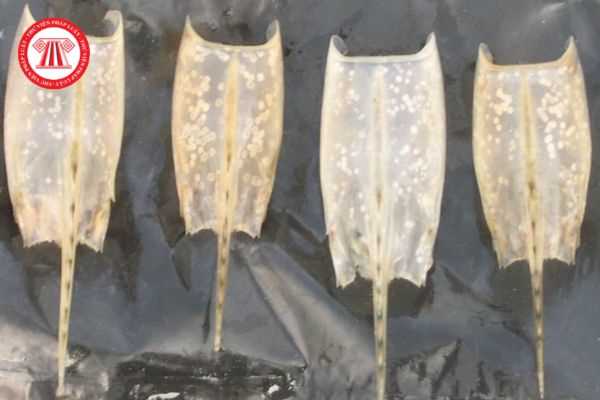
Tôm bị bệnh thường thể hiện dấu hiệu giảm ăn rõ rệt, đôi khi có trường hợp tăng cường sự bắt mồi hơn bình thường, sau vài ngày bỏ ăn, tôm dạt bờ, lờ đờ với dấu hiệu xuất hiện các đốm trắng tròn đường kính từ 0,5 - 2,0mm dưới lớp vỏ kitin đặc biệt là vùng đầu ngực và đốt bụng cuối cùng. Những đốm trắng này nằm trong lớp vỏ và không thể loại bỏ bằng việc chà sát. Trong trường hợp cấp tính, tôm bệnh có thể chuyển sang màu hồng đỏ. Hiện tượng chết có thể xảy ra ngay sau đó, tỉ lệ chết có thể lên đến khoảng từ 90 % đến 100 % trong vòng 3 ngày đến 7 ngày.

Tiêu chuẩn quốc gia TCVN 8710-3:2019 yêu về việc chẩn đoán lâm sàng trong việc chẩn đoán bệnh đốm trắng ở tôm do vi rút? (Hình từ Internet)
Việc chẩn đoán trong phòng thí nghiệm bằng phương pháp Nested PCR (Polymerase Chain Reaction) được quy định như thế nào?
Tại tiểu mục 6.1 Mục 6 Tiêu chuẩn quốc gia TCVN 8710-3:2019 quy định về việc chẩn đoán trong phòng thí nghiệm bằng phương pháp Nested PCR như sau:
* Lấy mẫu
Số lượng tôm trên mỗi mẫu phụ thuộc vào kích cỡ của tôm:
- Ấu trùng và hậu ấu trùng: 100 mg
- Tôm trưởng thành, tôm bố mẹ: lấy từ 5 con/mẫu đến 10 con/mẫu.
* Bảo quản mẫu
- Mẫu được bảo quản ở nhiệt độ từ 2°C đến 8 °C và chuyển đến phòng thí nghiệm trong vòng 48h sau khi lấy mẫu hoặc bảo quản trong etanol từ 96 % đến 100 % (3.1.1).
- Mẫu chuyển đến phòng thí nghiệm nếu chưa phân tích ngay phải được bảo quản ở nhiệt độ âm 20 °C đến âm 80 °C hoặc trong etanol từ 96 % đến 100 % (3.1.1).
* Chuẩn bị mẫu
- Đối với tôm giống, ấu trùng và hậu ấu trùng: Sử dụng nguyên con;
- Đối với tôm bố mẹ, tôm thương phẩm: Lấy mang, chân bơi, đuôi, giáp đầu ngực, máu, cơ bụng.
Lượng mẫu cần chuẩn bị: Khoảng 30 mg.
Mẫu được nghiền nhuyễn với tỷ lệ 1 thể tích mẫu trong 9 thể tích dung dịch muối đệm PBS (3.1.2), để tạo thành huyễn dịch 10 %, chia thành hai phần: một phần cho thực hiện xét nghiệm và một phần lưu trữ ở tủ âm (-80 °C).
* Cách tiến hành
- Tách chiết ADN
Sử dụng bộ kít tách chiết (3.2.3) thích hợp và an toàn theo hướng dẫn của nhà sản xuất.
Ví dụ: Sử dụng kit tách chiết ADN của Qiagen: DNeasy® Blood & Tissue Kit (250) (Cat No. 69506) [1]) (xem phụ lục B1).
Hoặc Sử dụng kit tách chiết TACO RNA/ADN extraction Kít (GeneReach Cat. No. atc-d/rna, 320 tests) [2]) (xem phụ lục B2).
- Chuẩn bị mồi
Phương pháp Nested PCR sử dụng cặp mồi 146F1/146R1 và 146F2/146R2 (3.2.1) để phát hiện vi rút đốm trắng. Trình tự cặp mồi (xem phụ lục C, Bảng C.1).
Mồi được chuẩn bị như sau:
- Mồi ở trạng thái đông khô phải được ly tâm nhanh bằng máy ly tâm nhanh spindown (4.1.5) trong 30 s để mồi lắng xuống đáy ống trước khi mở và hoàn nguyên. Dùng dung dịch đệm TE (3.2.9) để hoàn nguyên mồi ở nồng độ 100 µM làm gốc.
- Mồi được sử dụng ở nồng độ 20 µM: pha loãng mồi gốc bằng nước tinh khiết không có nuclease (3.2.11) (10 µl mồi gốc và 40 µl nước tinh khiết không có nuclease).
- Tiến hành phản ứng Nested PCR
Phản ứng khuếch đại được thực hiện trong máy nhân gen (4.1.1) theo phương pháp nested PCR bao gồm 2 giai đoạn (hoặc 2 bước): Giai đoạn 1 (bước 1), thực hiện phản ứng PCR sử dụng cặp mồi 146F1/146R1; Giai đoạn 2 (bước 2), thực hiện phản ứng nested PCR sử dụng cặp mồi 146F2/146R2, sử dụng kít nhân gen (3.2.4) theo hướng dẫn của nhà sản xuất (xem phụ lục C).
- Điện di
+ Chuẩn bị bản gel
Pha thạch với nồng độ agarose (3.2.12) từ 1,5 % đến 2 % bằng dung dịch đệm TBE 1X hoặc TAE 1X (3.2.6) vào chai thủy tinh 250 ml, lắc đều rồi đun sôi.
Khi nhiệt độ giảm xuống khoảng 40 °C đến 50 °C thì bổ sung 10 µl chất nhuộm màu (3.2.7) vào mỗi 100 ml thạch. Lắc nhẹ tránh tạo bọt để chất nhuộm màu tan đều.
Tiến hành đổ thạch vào khay điện di đã được cài lược; không nên đổ bản thạch dày quá 0,8 cm.
Khi bản thạch đông lại thì tiến hành gỡ lược khỏi bản thạch.
Chuyển bản gel vào bể điện di (4.1.6), đổ dung dịch đệm (TBE 1X hoặc TAE 1X) cùng loại với dung dịch pha thạch agarose đã đun vào bể điện di cho tới khi ngập bản thạch.
Chú thích: Có thể dùng các sản phẩm có sẵn chất nhuộm ADN để pha chế thạch agarose (ví dụ: Sybr safe ADN gel stain[3]) và sử dụng theo quy định của nhà sản xuất.
+ Chạy điện di
Hút 2 µl chất đệm tải mẫu (Loading dye 6X) (3.2.8) vào 8 µl sản phẩm PCR trộn đều và cho vào các giếng trên bản thạch.
Thực hiện điện di trong bộ điện di (4.1.6), chạy kèm theo thang chuẩn ADN (ladder) (3.2.10) để dự đoán kích thước sản phẩm khuếch đại. Hút 10 µl thang chuẩn ADN (ladder) (3.2.10) vào một giếng trên bản thạch.
Điện di ở hiệu điện thế 100 V trong thời gian 25 min.
+ Đọc kết quả
Sau khi điện di, đọc kết quả trên máy đọc gel (4.1.7).
Điều kiện phản ứng được công nhận khi:
- Mẫu đối chứng âm không có vạch sáng (không có sản phẩm khuếch đại).
- Mẫu đối chứng dương có vạch sáng kích thước 941 bp.
Với điều kiện phản ứng trên:
Kết quả mẫu thử dương tính khi:
- Tại giếng mẫu thử xuất hiện vạch sáng có kích thước 941 bp.
- Thang chuẩn ADN phân vạch rõ ràng.
Kết quả mẫu thử âm tính khi:
- Tại giếng mẫu thử không xuất hiện vạch sáng.
- Thang chuẩn ADN phân vạch rõ ràng
Việc chẩn đoán trong phòng thí nghiệm bằng phương pháp Realtime PCR được quy định như thế nào?
Tại tiểu mục 6.2 Mục 6 Tiêu chuẩn quốc gia TCVN 8710-3:2019 quy định về việc chẩn đoán trong phòng thí nghiệm bằng phương pháp Nested PCR như sau:
- Lấy mẫu (Theo 6.1.1 Tiêu chuẩn quốc gia TCVN 8710-3:2019)
- Bảo quản mẫu (Theo 6.1.2 Tiêu chuẩn quốc gia TCVN 8710-3:2019)
- Chuẩn bị mẫu (Theo 6.1.3 Tiêu chuẩn quốc gia TCVN 8710-3:2019)
- Cách tiến hành
+ Tách chiết ADN
Sử dụng bộ kít tách chiết (3.2.3) thích hợp và an toàn theo hướng dẫn của nhà sản xuất.
Ví dụ: Sử dụng kit tách chiết ADN: DNeasy®Blood & Tissue Kit (250) (Cat No. 69506)[4]) (xem phụ lục B).
+ Chuẩn bị mồi
Phương pháp Realtime PCR sử dụng cặp mồi WSSV1011F /WSSV1079R và đoạn dò WSSV-p (3.2.2) để phát hiện vi rút đốm trắng. Trình tự cặp mồi (xem phụ lục D, Bảng D.1).
Mồi được chuẩn bị như sau:
++ Mồi ở trạng thái đông khô phải được ly tâm nhanh bằng máy spindown (4.1.5) trong 30 s để mồi lắng xuống đáy ống trước khi mở và hoàn nguyên. Khi hoàn nguyên, nên dùng dung dịch đệm TE (3.2.9) để hoàn nguyên mồi ở nồng độ 100 µM làm gốc.
++ Mồi được sử dụng ở nồng độ 20 µM: pha loãng mồi gốc bằng nước tinh khiết không có nuclease (3.2.11) (10 µl mồi gốc và 40 µl nước tinh khiết không có nuclease).
++ Đoạn dò WSSV-p sử dụng nồng độ 6 µM: pha loãng đoạn dò bằng nước tinh khiết không có nuclease (3.2.11) (3 µl mồi gốc và 47 µl nước tinh khiết không có nuclease)
+ Tiến hành phản ứng realtime PCR
Phản ứng khuếch đại được thực hiện trong máy Realtime PCR (4.1.2) theo phương pháp Realtime PCR khuếch đại đoạn gen đặc hiệu của vi rút WSSV sử dụng cặp mồi đặc hiệu WSSV1011F /WSSV1079R và đoạn dò WSSV-p (3.2.2), sử dụng kít nhân gen (3.2.5) theo hướng dẫn của nhà sản xuất (xem phụ lục D).
+ Đọc kết quả
Điều kiện của phản ứng được công nhận khi:
++ Mẫu đối chứng âm phải cho kết quả âm tính (không có giá trị Ct).
- Mẫu đối chứng dương phải cho kết quả dương tính và có giá trị Ct so với giá trị Ct của mẫu đã được chuẩn độ trước đó có khoảng giá trị Ct = ± 2
Với điều kiện phản ứng như trên:
++ Mẫu có giá trị Ct < 35 được xem là dương tính
++ Mẫu không có giá trị Ct là âm tính
++ Mẫu có giá trị Ct trong khoảng 35 ≤ Ct ≤ 40 được xem là nghi ngờ.
Chú ý:
- Những mẫu nghi ngờ, cần được thực hiện xét nghiệm lại hoặc sử dụng phương pháp xét nghiệm tương đương khác để khẳng định kết quả.
- Phản ứng realtime PCR phải bao gồm: mẫu kiểm tra, mẫu kiểm chứng dương và mẫu kiểm chứng âm;
- Mẫu và nguyên liệu cho phản ứng realtime PCR cần đặt trong khay đá lạnh trong suốt quá trình chuẩn bị hỗn hợp phản ứng.
Võ Thị Mai Khanh
Quý khách cần hỏi thêm thông tin về Bệnh đốm trắng ở tôm có thể đặt câu hỏi tại đây.
- Quy trình chuyển đổi vàng miếng khác thành vàng miếng SJC của doanh nghiệp mua bán vàng miếng như thế nào?
- Lựa chọn chủ đầu tư dự án cải tạo nhà chung cư thông qua tổ chức đấu thầu được thực hiện trong trường hợp nào?
- Đất công trình thủy lợi thuộc nhóm đất nào? Được sử dụng để làm gì? Ai có trách nhiệm quản lý công trình thủy lợi?
- Lưu ý khi điền xếp loại kết quả đánh giá trong mẫu phiếu tự đánh giá của giáo viên mầm non mới nhất?
- Phụ lục đặc điểm kinh tế - kỹ thuật của thiết bị y tế thực hiện kê khai giá mới nhất? Tải về ở đâu?